人体内可以抑制HIV复制的天然免疫因子有哪些
来源:
1.APOBEC3G (A3G):A3G可以被打包进病毒颗粒,在病毒的逆转录过程中发挥抗病毒作用。其能够使新生DNA负链上的腺嘌呤或胞嘧啶脱氨基变为黄嘌呤或尿嘧啶,产生对病毒致死的G→A高突变,而APOBEC3G能被HIV-1的Vif蛋白拮抗。
2.SAMHD1:在树突状和髓系细胞中表达,通过影响磷酸水解酶活性降低dNTP水平,干扰HIV复制。并具有核酸酶活性,降解病毒RNA。SAMHD1能被Vpx和Vpr所拮抗。
3.Tetherin:是一种被干扰素α诱导产生的宿主限制性因子,可以将新生HIV病毒颗粒束缚在细胞表面,阻止病毒释放。Vpu拮抗Tetherin的功能,是HIV-1完成跨种传播的重要毒力因子。
4.转运蛋白(translocator protein, TSPO):位于线粒体膜上的TSPO可与线粒体相关ER膜上的VDAC相互作用改变膜电位,阻断活性氧物质的释放来降低内质网内的氧化状态,导致Env错误折叠并经由ERAD途径识别降解,最终使新生HIV-1病毒缺乏Env且传染性降低。
5.内质网甘露糖苷酶I (endoplasmic reticulum α 1,2-mannosidase I,ERMAN I):ERMan I在内质网中的高表达增加线粒体TSPO的表达,破坏了Env在内质网中正确折叠所必需的最佳氧化状态,使Env错误折叠,最终导致其降解。
6.鸟苷酸结合蛋白5(guanylate-binding protein 5, GBP5):GBP5是干扰素诱导的鸟苷三磷酸酶(GTPases)超家族成员之一,研究表明,GBP5可通过干扰高尔基体内包膜糖蛋白的N-连接寡糖糖基化修饰来影响HIV-1包膜糖蛋白的加工,增加了子代病毒包膜上未成熟gp160,降低了HIV-1的感染性。
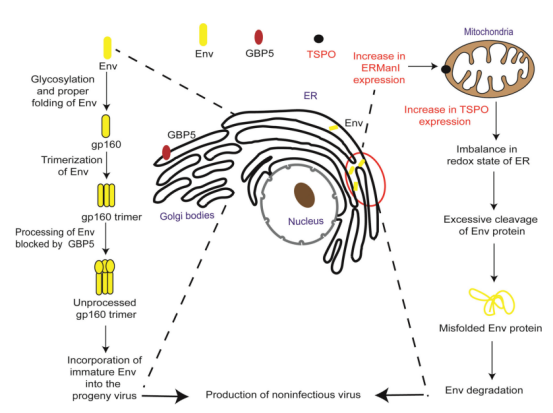
图1. TSPO、ERMAN I和GBP5在HIV-1复制过程中可能抑制作用机制示意图[1]
7.丝氨酸结合蛋白(serine incorporator, SERINC3/5): 在HIV-1缺乏负调节因子Nef或SERINC5自身过表达的情况下,SERINC5能和对它有高亲和力的子代病毒包膜结合,以此抑制HIV-1和宿主细胞之间小融合孔的形成,从而限制了HIV-1与宿主细胞的融合,最终降低了HIV-1的感染力。SERINC蛋白还可能与HIV-1的Env蛋白相互作用,引起Env蛋白的构象变化,减缓HIV-1与宿主细胞的融合过程,并使HIV-1暴露出能与各种中和抗体结合的表位,从而对HIV-1复制起到一定抑制作用。
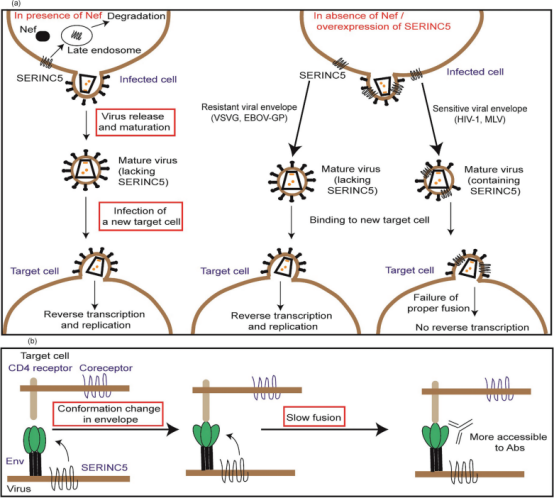
图2. SERINC5 在HIV-1复制过程中可能抑制作用机制示意图[1]
8.锌指抗病毒蛋白(zinc-finger antiviral protein, ZAP): ZAP过表达可通过阻止HIV-1 mRNA翻译来抑制HIV-1的复制。其机制可能是:A. ZAP与宿主细胞eIF4G结合,使病毒mRNA不能成功进行翻译。B. ZAP可通过与病毒mRNA结合、与ZAP结合反应元件(ZRE)结合或间接影响RNA解旋酶p72/DDX17来募集具有mRNA降解酶活性的物质,从而降解病毒mRNA。
9.TRAB结构域包含蛋白2A (TRAB domain-containing protein 2A ,TRABD2A):该蛋白家族成员主要包括TRABD2A和TRABD2B。TRABD2A主要表达于静息CD4+T细胞表面,TRABD2A在HIV-1感染中能够发挥抗病毒功能,通过降解CD4+T细胞膜上的病毒结构蛋白Gag以限制HIV-1在静息CD4+T细胞中的子代组装,进而抑制HIV-1复制。
宿主限制性因子的鉴定仍是研究抗HIV天然免疫的热点,科学家不断发现的抗HIV天然限制因子,为理解HIV发生跨种传播的机制,开发抗HIV/AIDS的新疗法提供了一个潜在的策略。
参考文献
[1]. Ghimire, D., M. Rai and R. Gaur, Novel host restriction factors implicated in HIV-1 replication. Journal of general virology, 2018. 99(4): p. 435.
[2]. Liang, G., et al., Membrane metalloprotease TRABD2A restricts HIV-1 progeny production in resting CD4(+) T cells by degrading viral Gag polyprotein. Nat Immunol, 2019. 20(6): p. 711-723.



 京公网安备 11011402013011号
京公网安备 11011402013011号